หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
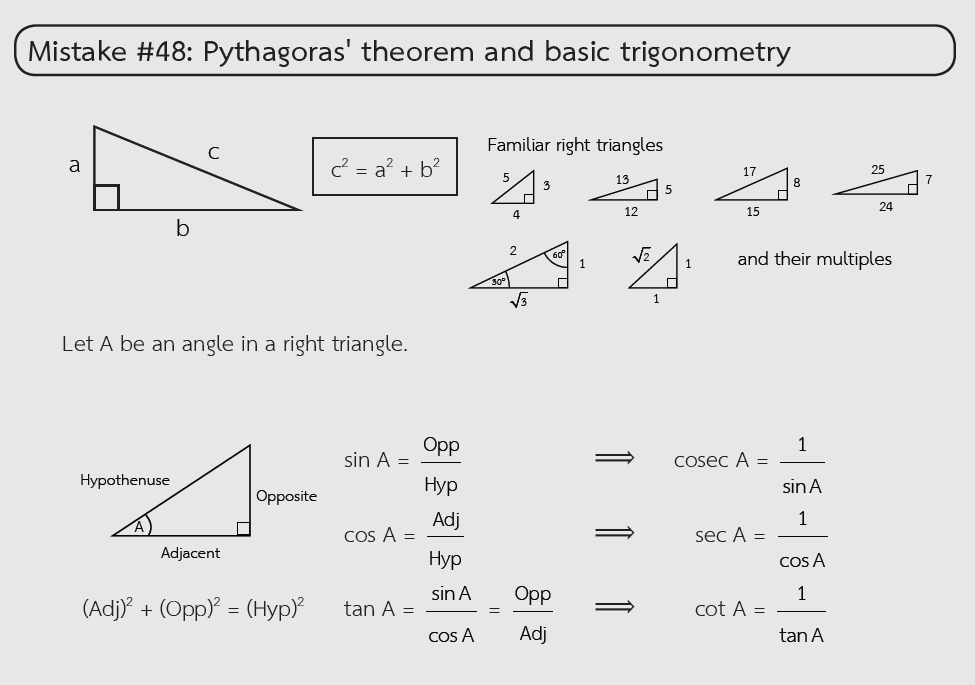
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN SAT MATH
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN SAT MATH
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN SAT MATH
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN SAT MATH
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
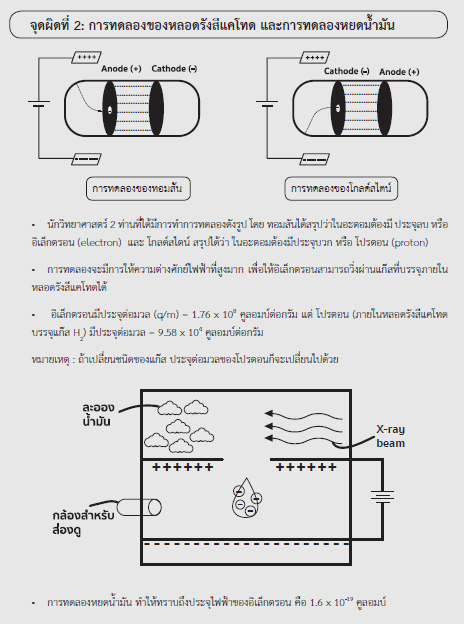
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN CHEMISTRY
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂
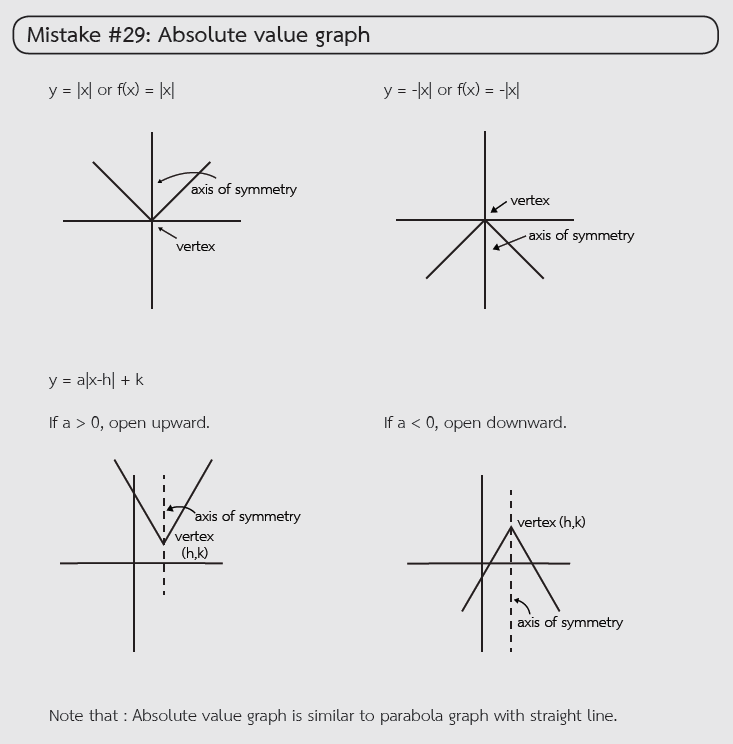
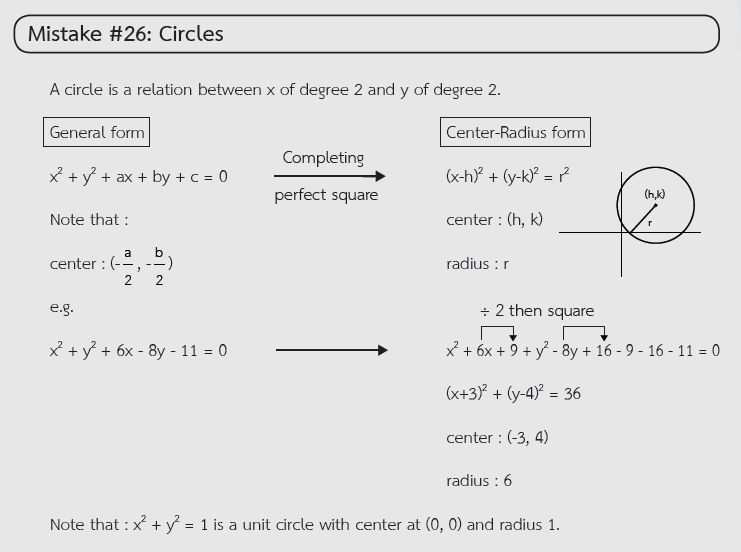
ตัวอย่างจุดผิดที่พบบ่อยในการสอบจากหนังสือ STUDYPLAN MATHEMATICS
หากน้องๆสนใจหนังสือสามารถติดต่อได้ผ่านทาง Facebook: www.facebook.com/studyplan – studyplan แอปวางแผนเตรียมสอบ, Instagram: @studyplanapp หรือ กดขอดูเฉลยในแอปนี้ได้เลยครับ 🙂